雲南發布中藥配方顆粒質量標准制定工作程序及申報資料要求
3月15日
雲南省藥品監督管理局下發
《雲南省中藥配方顆粒質量標准制定工作程序及申報資料要求》(試行)的通知
通知全文如下

雲南省中藥配方顆粒質量標准制定工作程序及申報資料要求(試行)
(雲藥監注〔2021〕9號)
各有關單位:
爲貫徹落實《國家藥監局 國家中醫藥局 國家衛生健康委 國家醫保局關于結束中藥配方顆粒試點工作的公告》(2021年第22號)的文件精神,規範雲南省中藥配方顆粒的標准研究,結合雲南省中藥配方顆粒産業發展實際,我局組織制訂了《雲南省中藥配方顆粒質量標准制定工作程序及申報資料要求》(試行),現予以下發,自下發之日起施行。
雲南省藥品監督管理局
2021年3月15日
雲南省中藥配方顆粒質量標准制定
工作程序及申報資料要求(試行)
一、目的
爲確保雲南省中藥配方顆粒質量標准收載品種的規範開展,明確我省中藥配方顆粒質量標准申報及審核的工作流程,特制定本工作程序。
本程序主要適用于雲南省中藥配方顆粒生産企業按照國家藥監局《中藥配方顆粒質量控制與標准制定技術要求》完成起草申請納入雲南省中藥配方顆粒質量標准時的標准複核及技術審核工作。
二、工作程序
(一)基本原則
1.品種遴選
標准起草單位根據臨床使用需求,確定需起草/修訂質量標准的品種。遴選的品種需滿足以下要求:
(1)國家中藥配方顆粒質量標准未收載;
(2)對應的中藥材符合現行版《中國藥典》、其他國家標准或《雲南省中藥材標准》等省級中藥材標准中的相關規定。對應的中藥飲片如無法定標准的,企業應結合中藥材實際質量情況和工藝控制水平制定企業內控標准及關鍵控制指標,並提供3批檢驗報告書。
應固定藥材基原、采收時間、産地加工方法、藥用部位、炮制方法等並說明選擇依據。其中,同時收載在雲南省地方標准與其他省份地方標准中,具有相同基原的品種,應優先執行雲南省地方標准。
2.標准制定研究
雲南省中藥配方顆粒質量標准的制定,應按照國家藥監局《中藥配方顆粒質量控制與標准制定技術要求》開展全檢驗項目的研究,並按申報資料要求提交相應的研究資料。研究後認爲可不納入標准正文的檢驗項目,應在標准起草說明中闡述理由。
(二)申報
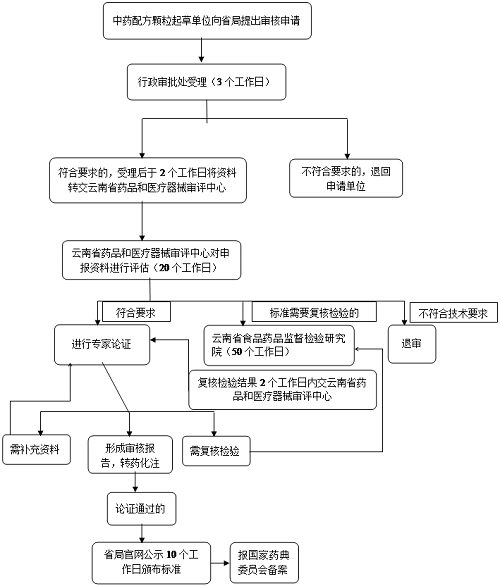
質量標准申報單位按照相關技術要求完成標准的起草,于2021年5月15日前按申報資料的要求向雲南省藥監局提交相應技術資料(一式二份),提出審核申請。雲南省藥監局行政審批處于3個工作日內完成資料完整性的形式審查,資料齊全、規範的,予以受理,發放受理通知書。
(三)審核與發布
雲南省藥監局行政審批處受理後,2個工作日轉雲南省藥品和醫療器械審評中心(以下簡稱省藥械審評中心),省藥械審評中心在20個工作日內對申報資料進行評估,經評估,認爲申報資料達到《中藥配方顆粒質量控制與標准制定技術要求》的,組織專家進行論證;認爲申報品種的質量標准需進行全部或部分項目複核檢驗的,轉雲南省食藥檢院,雲南省食藥檢院在50個工作日內完成,複核檢驗結果在2個工作日內返回省藥械審評中心組織專家進行論證;認爲申報資料研究內容尚未達到《中藥配方顆粒質量控制與標准制定技術要求》的,予以退審。省藥械審評中心可根據專家組的論證意見發起的複核檢驗或向申報單位發出《補充資料通知》。
經論證後,省藥械審評中心形成審核報告轉省局藥化注冊處。論證通過的,省局藥化注冊處對其質量標准及起草說明在省局官網公示10個工作日,公示期滿無異議的,省藥監局按程序發布並在標准發布後30日內將標准批准證明文件、標准文本及編制說明報國家藥典委員會備案。
三、申報資料要求
本申報資料要求適用于雲南省中藥配方顆粒品種的標准研究。申報資料應按照項目標號提供,對應項目無相關信息或研究資料的,項目編號和名稱也應保留,可在項下注明“無相關研究資料”或“不適用”。申報資料的撰寫應參考相關法規、技術要求及技術指導原則的相關規定。
(一)承諾函
申報單位應承諾申報資料的真實性、不侵權性。申報資料由多家單位共同完成的,落款處應逐一列明完成單位的名稱。
(二)申報資料目錄
應列明申報資料的文件名稱清單,並標注對應的頁碼範圍。申報資料應包含以下內容:
資料1.基本情況
資料2.原料研究資料
資料3.輔料研究資料
資料4.標准湯劑研究資料
資料5.制備工藝研究資料
資料6.與質量相關的其他研究資料
資料7.質量標准研究資料
資料8.穩定性研究資料
資料9.樣品檢驗報告書
資料10.藥包材研究資料
資料11.複核檢驗報告書和複核意見
資料12.標准物質信息及研究資料
1.基本情況
包括概述、文獻資料綜述、研究資料綜述和證明文件四部分,主要包括以下內容:
(1)概述:依據國家藥監局《中藥配方顆粒質量控制與標准制定技術要求》介紹本品主要的研究概況、結論及量值傳遞的基本情況等。
(2)文獻資料綜述:文獻資料綜述對本品所用藥材的資源、栽培、飲片炮制、化學成分、質量分析、藥理作用、臨床應用、配方顆粒等方面的研究文獻資料進行綜述。
(3)研究資料綜述:對原輔料、標准湯劑、配方顆粒的生産工藝、質量標准、穩定性試驗、樣品檢驗等各項研究資料進行簡要綜述。
(4)證明文件:申報人合法登記證明文件、《藥品生産許可證》複印件,並同時具有中藥飲片及顆粒劑生産範圍。
2.原料研究資料
包括原料基本情況、原料質量標准、原料檢驗報告、供貨協議以及其他資料,主要包括以下內容:
(1)原料基本情況:詳細說明本品所用原料的藥材基原、藥用部位、采收、地理分布和主要産地,産地加工、固定的産地、基地建設、資源狀況等,飲片炮制方法及其工藝參數、包裝和貯藏方法。
(2)原料質量標准:提供本品所用原料藥材和飲片的法定質量標准、本企業研究制定的內控質量標准及關鍵控制指標。
(3)原料檢驗報告:提供本品研究使用的3批原料藥材和飲片的質量檢驗報告。
(4)原料供貨協議:屬于外購的原料,提供本品已確定原料供貨商的供貨協議和購貨發票。
(5)其它資料:申報單位認爲必須提供的其它與原料研究有關的資料
3.輔料研究資料
包括輔料來源、輔料質量標准、輔料檢驗報告及供貨協議。
(1)輔料來源:詳細介紹本品所用輔料的來源(提供生産企業的資質證明文件和/輔料的批准證明文件)。
(2)輔料質量標准:提供本品所用輔料的法定質量標准和本企業現行內控質量標准。如經精制,還需說明精制方法。
(3)輔料檢驗報告:提供本品近期使用的1~3批輔料的申報單位檢驗報告書。
(4)輔料供貨協議:提供本品已確定輔料供貨商的供貨協議和購貨發票。
4.標准湯劑研究資料
包括標准湯劑工藝研究資料、標准湯劑質量指標、研究小結及其他。
(1)工藝研究資料:詳細提供標准湯劑的提取、固液分離、濃縮、凍幹等工藝優化研究資料。
(2)標准湯劑質量指標:包括出膏率、有效成分含量、指紋圖譜或特征圖譜等。根據15批以上標准湯劑的測定結果,制定相應的質量指標,提供詳細的測定數據,及主要量值傳遞的數據範圍。
(3)小結:應對標准湯劑的原料選擇、工藝考察、含量測定、特征圖譜等研究內容的依據及過程進行小結。
(4)其它:申報單位認爲必須提供的其它與標准湯劑相關的研究資料。
5.制備工藝研究資料
包括制備工藝研究資料、生産試驗與過程控制及其他資料
(1)制備工藝研究資料:以標准湯劑爲基礎,提供本品包括工藝參數在內的詳細的現行生産工藝規程(包括原料的前處理、飲片規格、提取、濃縮、制粒、幹燥包裝等工藝過程和工藝參數)。提供本品詳細的生産工藝流程,包括關鍵工藝參數、潔淨區級別。詳細提供本品提取、濃縮、幹燥、制劑處方、制粒和清潔工藝等工藝研究資料,說明制備工藝建立、制成量確立的合理性。
(2)生産試驗與過程控制:以出膏率、特征或指紋圖譜、指標成分含量、轉移率來說明從原料—標准湯劑—中間體—成品的量值傳遞數據的變化情況,詳細提供三批生産數據和過程控制的條件和參數。提供中間體標准。
(3)其它:申報單位認爲必須提供的其它工藝研究及驗證資料。
6.與質量相關的其他研究資料
(1)質量研究文獻資料:提供本品質量相關的文獻研究綜述及文獻資料。
(2)質量研究資料:提供産品控制安全有效風險點的過程管控研究資料,提供詳細的研究數據,提供本品化學成分研究、定性定量分析方法研究、生物學質控方法研究等資料。
(3)其它:藥品生産企業認爲必須提供的其它質量研究相關資料。
7.質量標准研究資料
(1)質量標准正文:提供本品擬定的質量標准和企業內控標准。
(2)質量標准起草說明:提供質量標准的建立和方法學驗證資料,並提供詳細的研究數據。
8.穩定性研究資料
按實際研究進度情況提供本品穩定性考察試驗資料,明確儲存條件和存儲時間,提供本品三批産品留樣穩定性考察數據及分析、結論,後續持續開展穩定性研究。
9.樣品檢驗報告書
提供連續三批規模化生産樣品的檢驗報告書。
10.藥包材研究資料
(1)藥包材來源:詳細介紹本品所用藥包材的來源(提供生産企業的資質證明文件和/藥包材的批准證明文件)。
(2)藥包材質量標准:提供本品所用藥包材的法定質量標准和本企業現行內控質量標准。
(3)藥包材檢驗報告:提供本品近期使用的1~3批藥包材的申報單位檢驗報告書。
(4)藥包材供貨協議:提供本品已確定藥包材供貨商的供貨協議和購貨發票。
(5)相容性試驗研究資料。(如適用)
11.複核檢驗報告書和複核意見(如適用)
提供與自檢的3批規模化生産的中藥配方顆粒樣品相同批次的複核檢驗報告書和複核意見。對複核意見提出的相關問題,應在質量標准起草說明中詳細闡述采納或不采納的情況及理由。
12.標准物質研究資料
列明上述研究中使用標准物質的名稱、生産單位、說明書、批號等信息。
中藥配方顆粒質量標准中使用的標准物質,如使用非國家藥品標准物質的,申請標准複核(或審核)時,還應按照雲南省中藥(民族藥)標准物質研制的相關要求,提供新增標准物質研制、標定等資料和實物樣品。
雲南省中藥配方顆粒標准申報工作流程
I 版權聲明
文章來源:“雲南藥品安全(雲南省藥品監督管理局官方微信)“,版權歸相關權利人所有,如有轉載不當,隨時聯系刪除。
雲南藥品安全原文:雲南發布中藥配方顆粒質量標准制定工作程序及申報資料要求
雲南省藥品監督管理局官網全文:http://mpa.yn.gov.cn/newsite/ZwgkNewsView.aspx?ID=eca7390c-7b87-414a-b396-773d525250fb


